- Startseite
- Forschungsabteilungen
- Spektroskopie / Bildgebung
- Forschungsergebnisse
- Multimodale nichtlineare Mikroskopie zur Therapieüberwachung der Behandlung mit kaltem atmosphärischem Plasma
Multimodale nichtlineare Mikroskopie zur Therapieüberwachung der Behandlung mit kaltem atmosphärischem Plasma

14.07.2020
Von Tobias Meyer // Hyeonsoo Bae // Sybille Hasse // Jörn Winter // Thomas von Woedtke // Michael Schmitt // Klaus-Dieter Weltmann // Juergen Popp
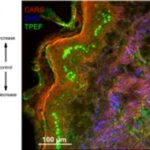
Die hier vorgestellte Arbeit wurde 2019 unter dem Titel Multimodal nonlinear microscopy for therapy monitoring of cold atmospheric plasma treatment veröffentlicht.[1] Eine fehlerhafte Wundheilung betrifft Millionen von Menschen in der westlichen Welt, und kaltes atmosphärisches Plasma (CAP) ist eine mögliche Behandlung, die sogar im Falle von multiresistenten Bakterien wirksam ist. Die zunehmende Verbreitung multiresistenter Bakterien stellt eine große Herausforderung für die öffentliche Gesundheit in den entwickelten Ländern dar, insbesondere vor dem Hintergrund einer alternden Bevölkerung. Es besteht daher ein großer Bedarf an solchen alternativen Therapien wie CAP, insbesondere für die Behandlung chronischer Wunden. Bislang hat sich die direkte Anwendung von CAP am oder im menschlichen Körper zu therapeutischen Zwecken bei der Behandlung chronischer und entzündeter Wunden, einschließlich Wunden, die mit multiresistenten Mikroben infiziert sind, als sehr wirksam erwiesen, obgleich die Mechanismen dahinter noch nicht vollständig verstanden sind. Darüber hinaus fehlen Instrumente zur Überwachung der Behandlung, z.B. um zu sehen, ob eine Fläche bereits ausreichend behandelt wurde. Der multimodale nichtlineare Bildgebungsansatz, der kohärente Anti-Stokes-Raman-Streuung (CARS), Zwei-Photonen-angeregte Fluoreszenz (TPEF) und die Erzeugung der zweiten Harmonischen (SHG) kombiniert und seit vielen Jahren am Leibniz-IPHT erforscht wird, wurde durch Zwei-Photonen-angeregte Fluoreszenz-Lebensdauer-Bildgebung (FLIM) zur markerfreien Überwachung der Effizienz der CAP-Behandlung an menschlichen Haut- und Schleimhautproben ergänzt. Der Einfluss von Plasmaeffekten durch Variation der Plasmaparameter (wie bspw. Behandlungsdauer, Gaszusammensetzung und Plasmaquelle) wurde untersucht. CARS und SHG weisen die Integrität der Gewebestruktur nach und visualisieren die Gewebemorphologie bzw. ‑zusammensetzung, während TPEF und FLIM zur Überwachung der Behandlung verwendet wurden, indem eine Zunahme der Gesamtautofluoreszenz beobachtet wurde. Durch Korrelation mit histochemischer Färbung und FLIM konnte eine hochgradig lokalisierte Zunahme der Fluoreszenz dem Melanin zugeordnet werden. Die Grundidee dieses Forschungsprojekts ist in Abbildung 1 dargestellt. Infizierte Wunden werden mit CAP behandelt, was zur Inaktivierung von Bakterien durch Mechanismen führt, die weiter untersucht und besser verstanden werden müssen. Um dieses Ziel zu erreichen, wird die multimodale nichtlineare Mikroskopie auf den Behandlungsbereich angewendet, um nach Biomarkern für die Überwachung der CAP-Behandlung zu suchen. Um nach Biomarkern für die Überwachung der CAP-Behandlung zu suchen, wurde multimodale nichtlineare Bildgebung, die CARS, SHG und 2P-FLIM kombiniert, angewandt, um dünne Gewebeschnitte von Haut und Schleimhaut zu untersuchen. Wie in Abbildung 2 A dargestellt, wurden verschiedene experimentelle Bedingungen für die CAP-Behandlung analysiert, wobei die Parameter Behandlungszeit, Plasmaquelle, Gaszusammensetzung und Probe variiert wurden. Die Schnitte wurden vor und nach der CAP-Behandlung analysiert, um nach spektroskopischen Veränderungen im Zusammenhang mit der CAP-Behandlung zu suchen. Für alle Parameter wurde eine signifikante Zunahme der Autofluoreszenz nach der Behandlung beobachtet (Abbildung 2 A). In Abbildung 2 B wurde eine menschliche Hautgewebeprobe mit dem kINPen MED®-Gerät 20 s lang mit einem Ar-Sauerstoff-Gasgemisch behandelt. Der Anstieg der Autofluoreszenz ist hauptsächlich in der proliferierenden und stoffwechselaktiven Basalzellschicht, d.h. den Melanozyten innerhalb des Stratum basale, lokalisiert. Diese Zellen sind ebenfalls reich an Melanin, wie der Vergleich mit der AgNO3-Färbung für Melanin zeigt, was die Lokalisierung der CAP-induzierten Zunahme der Autofluoreszenz innerhalb der Melaninschicht beweist (siehe Abbildung 2 C).
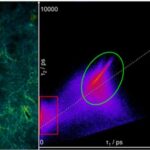
Um den Ursprung der Autofluoreszenz-Zunahme weiter zu analysieren, wurde die Zwei-Photonen-FLIM eingesetzt. Um zu beweisen, dass die beobachtete starke Fluoreszenz innerhalb des Epithels auf Melanin zurückzuführen ist, wurde Melanin selektiv nur mit dem Pumplaser bei 670 nm angeregt, was am besten zur Zwei-Photonen-Absorption von Melanin passt. Die Zwei-Photonen-Absorption von Melanin ist spektral breit, nimmt aber von 300 bis 700 nm ab. Die Emissionsspitze liegt zwischen 450 und 600 nm, so dass der verwendete Filter in den Melanin-Emissionsbereich passt. Die Fluoreszenzlebensdauer von Melanin liegt Berichten zufolge im Bereich von 100-150 ps. In Abbildung 3 A ist die kurzlebige Komponente der Zwei-Photonen-FLIM des bei 670 nm angeregten Gewebeschnitts der menschlichen Haut dargestellt. Die Anregung bei 670 nm führt zu einer hellen Emission aus der Basalzellschicht, die durch eine erste Lebensdauerkomponente von 50 ps gekennzeichnet ist, viel niedriger als die Lebensdauer von freiem NAD(P)H von 400 ps, aber charakteristisch für Melanin. Das 2D-Histogramm der Lebensdauern t1und t2 in Abbildung 3 B zeigt zwei rot und grün markierte Pixelcluster. Der rote Cluster entspricht dem Melanin, siehe Bild oben links. Der grüne Cluster repräsentiert Fluoreszenz aus den anderen Gewebebereichen.
Zusammenfassend konnte gezeigt werden, dass die multimodale nichtlineare Mikroskopie, die SHG, CARS, TPEF und 2P-FLIM kombiniert, ein leistungsfähiges diagnostisches Werkzeug zur Überwachung und Untersuchung der Mechanismen der CAP-Behandlung auf molekularer Ebene ohne Verwendung exogener Marker ist. Durch die Verwendung spezifischer Anregungs- und Emissionswellenlängen, die an autofluoreszierende Markermoleküle angepasst sind, glauben wir, dass die Signale, die mit der CAP-Behandlung korrelieren, signifikant erhöht werden können und charakteristische Lebenszeitveränderungen beobachtet und mit spezifischen molekularen Markern korreliert werden können. 2P-FLIM ist ein wertvolles Werkzeug zur Untersuchung der durch die CAP-Behandlung induzierten Erzeugung reaktiver Sauerstoffspezies (ROS), die die endogene Fluoreszenz modifizieren, z.B. durch Aktivierung emissionsfreier Abregungspfade.