- Startseite
- Forschungsabteilungen
- Spektroskopie / Bildgebung
- Forschungsergebnisse
- Blick ins Körperinnere: Dem Krebs auf der Spur
Blick ins Körperinnere: Dem Krebs auf der Spur
26.08.2022
Weltweit erkranken jährlich circa 19,3 Millionen Menschen an Krebs1. Je eher ein Tumor entdeckt und behandelt werden kann, desto besser stehen die Heilungschancen für betroffene Patientinnen und Patienten. So besteht in der Tumorchirurgie ein großer Bedarf an neuen Technologien, die in der Lage sind, Tumore exakt zu lokalisieren, um diese möglichst vollständig zu entfernen, und die eine zuverlässige Tumortypisierung und -einstufung ermöglichen, um schnell einen individuellen und auf die Patientin bzw. den Patienten zugeschnittenen Therapieplan einzuleiten.
Das Leibniz-IPHT arbeitet an verschiedenen endospektroskopischen Lösungen, um diese bisher nur unzureichend adressierten medizinischen Probleme zu lösen: Ein multimodales bildgebendes Endoskop-Konzept bietet das Potential, tumoröses von gesundem Gewebe direkt während einer Operation unterscheiden zu können, indem es räumlich hochaufgelöste Gewebebilder, die sowohl morphologische als biochemische Informationen enthalten, generiert. Um Tumore noch eingehender hinsichtlich Tumor-Grading und -Staging zu charakterisieren, wurde das invaScope – ein Raman-basiertes System – entwickelt, das es Ärztinnen und Ärzten ermöglichen soll, auffälliges Tumorgewebe punktgenau, markerfrei und ohne die Entnahme einer Biopsie histopathologisch zu charakterisieren.
Blasenkrebs mittels optischer Biopsie invivocharakterisieren
Blasenkrebs rangiert auf Platz zehn der am häufigsten diagnostizierten Karzinome weltweit. Männer erkranken deutlich häufiger als Frauen. 2020 starben 212.536 Erkrankte und damit fast 40 Prozent der Blasenkrebs-Betroffenen an ihrer Erkrankung2. In der Statistik der Todesfälle liegt Blasenkrebs neben Lungenkrebs, Krebs des Verdauungstraktes und Brustkrebs auf Platz 13. Eine verbesserte Diagnose erhöht die Heilungschancen deutlich.
Doch bis ein Harnblasenkarzinom eindeutig diagnostiziert werden kann, dauert es meist einige Tage bis hin zu mehreren Wochen, in denen Betroffene in Ungewissheit leben. Bei Krebsverdacht entnehmen Medizinerinnen und Mediziner eine Gewebeprobe aus der Harnblase, um eine harmlose Gewebeveränderung von einem bösartigen Karzinom differenzieren zu können. In der histopathologischen Untersuchung wird die Probe anschließend unter dem Mikroskop analysiert. Lautet die Diagnose „Krebs“, folgen weitere Operationen sowie begleitende Therapiemaßnahmen.
Die histopathologische Untersuchung liefert jedoch lediglich Aussagen zu morphologischen Gewebemerkmalen, wie Struktur und Form der entnommenen Zellen. Bedeutende biochemische Informationen werden nicht erfasst. Ein molekularer Fingerabdruck betroffener Zellen würde eine genauere diagnostische Charakterisierung des Tumors ermöglichen und dabei helfen, den Verlauf der Krankheit besser prognostizieren zu können.
Im Bild:
Das Endomikroskop soll Ärztinnen und Ärzte bei der Entfernung von Tumoren präzise unterstützen.
Um die Blasenkrebs-Diagnostik zu verbessern und zugleich die Zeit der Unsicherheit für Betroffene zu verkürzen, startete 2016 das EU-Projekt „MIB“ (Multimodal, endoscopic biophotonic imaging of bladder cancer for point-of-care diagnosis).
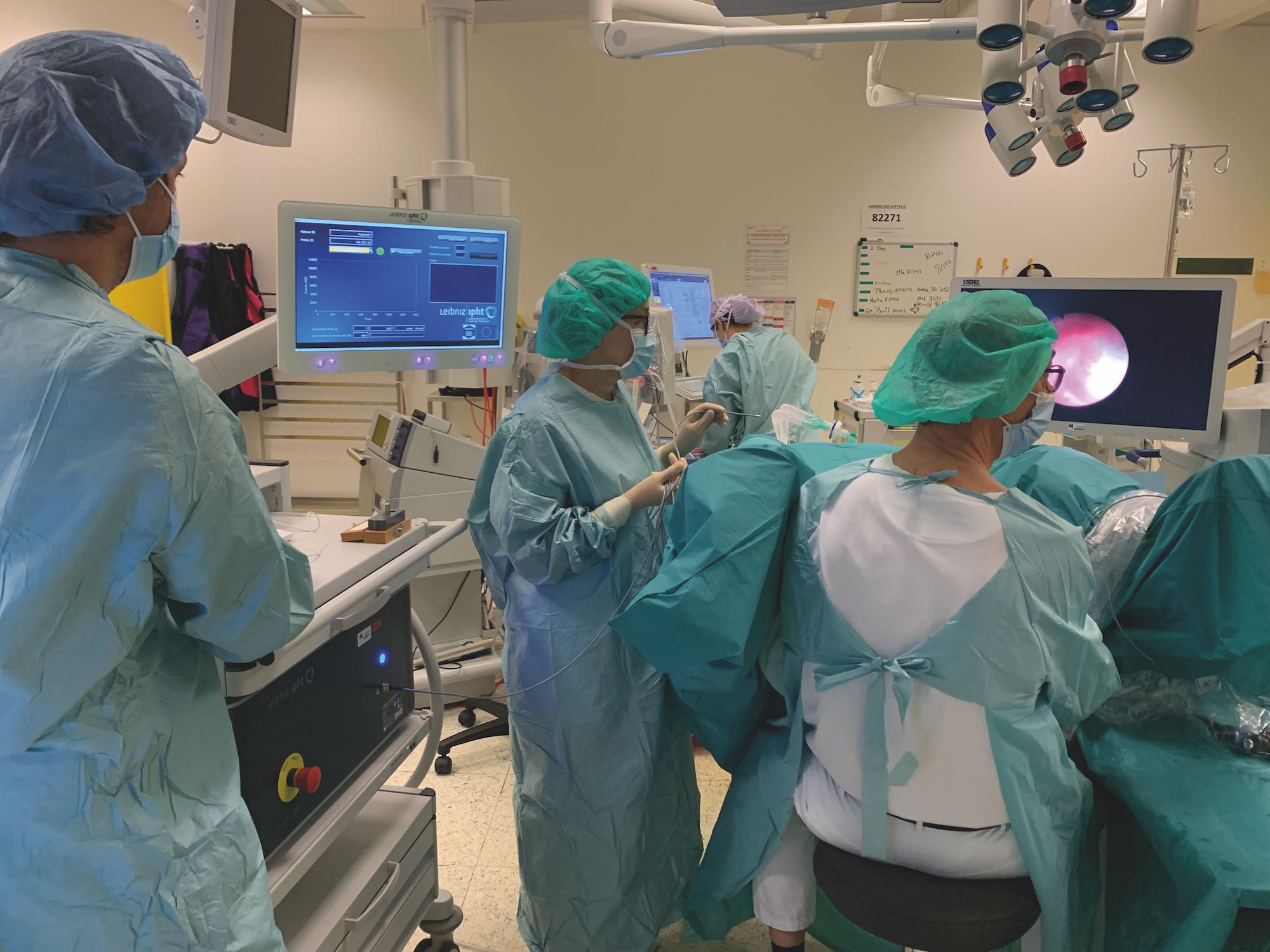
Gemeinsam mit zehn europäischen Partnereinrichtungen stellte sich das Leibniz-IPHT im Rahmen des Projektes der Aufgabe, ein kompaktes bildgebendes endoskopisches System zur Erkennung von Blasenkrebs zu entwickeln. „Das invaScope soll Ärztinnen und Ärzte bei der Charakterisierung von Blasengewebe wirkungsvoll unterstützen. Schnell und schmerzfrei wird die Tumordiagnose direkt in der Harnblase und in Echtzeit möglich sein. Befunde können so innerhalb kürzester Zeit vorliegen und Gesundheitsrisiken für Patientinnen und Patienten werden deutlich reduziert. Denn Eingriffe, wie Blasenspiegelungen, können für Betroffene mit Komplikationen, beispielsweise mit Blutungen, Blasenperforationen oder Infektionen, verbunden sein“, erklärt Prof. Dr. Iwan Schie, Arbeitsgruppenleiter für Multimodale Instrumentierung in der Abteilung Spektroskopie / Bildgebung am Leibniz-IPHT.
Eine spezielle Herausforderung auf dem Weg zum System war die Entwicklung einer kliniktauglichen endoskopischen Fasersonde. Ziel war es, die Fasersonde äußerst dünn, flexibel und robust zu gestalten, so dass der Zugang zur Blase über die Harnröhre unkompliziert möglich ist. Wichtig war vor allem, dass kein umliegendes Gewebe verletzt wird, die Untersuchung für Patientinnen und Patienten mit minimalem Risiko verbunden sowie schmerzfrei ist. Auch musste die Sonde biokompatibel und sterilisierbar sein. Durch die enge Zusammenarbeit mit Ärztinnen und Ärzten der Region Hovedstaden in Dänemark und den Medizintechnikherstellern Blazejewski MEDI-TECH GmbH und 2M Engineering konnten die anwendungsbezogenen und regulatorischen Anforderungen noch während der Forschung berücksichtigt werden.
„Mit der Europäischen Verordnung für Medizinprodukte (Medical Device Regulation, MDR) sind sehr hohe Anforderungen hinsichtlich Dokumentation, Funktionalität und Sicherheit an Geräte für die klinisch-investigative Forschung verbunden. Für uns als Leibniz-IPHT ist die Entwicklung des invaScopes die erste Realisierung eines Systems für die In-vivo-Anwendung am Menschen – ganz im Sinne von ‚From Ideas to Instruments‘ “, erläutert Iwan Schie.
Im Bild:
Kompakt und felxibel: Das invaScope, weches Iwan Schie (rechts) gemeinsam mit seinem Team entwickelte, vereint alle nötigen Komponenten zur Diagnostik von Blasenkrebs in einem kompakten Design
In Ex-vivo-Studien wiesen die Forschenden zunächst an Biopsien nach, dass insbesondere die Raman-Spektroskopie für die Diagnostik von Blasenkrebs und die Tumor-Grad-Differenzierung geeignet ist. Markierungsfrei ermöglicht sie die biochemische Charakterisierung von Gewebeproben. Mit einer Genauigkeit von 92 Prozent konnte zwischen gesundem und tumorösem Gewebe unterschieden werden. Bei der Differenzierung zwischen hochgradig bösartigem und weniger bösartigem Gewebe betrug die Genauigkeit 84 Prozent.
Die diagnostische Leistungsfähigkeit verbessert sich durch die Kombination verschiedener optischer Verfahren. „In Zusammenarbeit mit der Medizinischen Universität Wien konnten wir zeigen, dass sich unterschiedliche optische Methoden gut kombinieren lassen und sich bei der Diagnose ergänzen. Die Verbindung der optischen Kohärenztomographie, kurz OCT, und Raman-Spektroskopie bietet den Vorteil, sowohl tiefenaufgelöste strukturelle als auch molekulare Informationen aus Proben gewinnen zu können. Ärztinnen und Ärzte erhalten damit umfassende und aussagekräftige diagnostische Informationen über die Aggressivität und das Stadium eines Blasenkarzinoms“, führt Iwan Schie weiter aus.
Die Arbeiten am endoskopischen System mit faseroptischer Raman-Sonde konnten im Jahr 2021 abgeschlossen werden. Die entwickelte Sonde ist mehrfach sterilisierbar und somit wiederverwendbar. Alle für die Raman-Spektroskopie notwendigen Elemente, wie Laser, Spektrometer und Kamera, sind in einem kompakten und spritzwassergeschützten Gehäuse integriert und werden durch eine speziell für den klinischen Einsatz entwickelte Software ergänzt. Das Raman-System ist auf einem medizinischen Gerätewagen installiert und kann in Operationssälen oder Ambulanzen flexibel zum Einsatz kommen.
Im Bild:
Endoskopische, faseroptische Raman-Sonde, die gesundes und krankhaftes gewebe unterscheiden hilft
Im Kopenhagener Herlev Krankenhaus in Dänemark wurde das invaScope-System Ende 2021 im Rahmen einer klinischen Studie einem Praxistest unterzogen. Mit dem neuen Instrument konnten die Medizinerinnen und Mediziner die Blasenwand bei 20 Studienteilnehmern jeweils innerhalb weniger Minuten mittels Raman-Spektroskopie untersuchen. Dazu wurde die Sonde durch den Arbeitskanal eines Nephroskops in die Blase eingeführt, die Sondenspitze in Kontakt zur Blasenwand gebracht und die Messungen gestartet. Eine an das System angeschlossene Hellfeldkamera lieferte zeitgleich Aufnahmen aus dem Körperinneren und unterstützte die Auswahl der Geweberegion.
„Es war faszinierend, die Ergebnisse unserer Arbeit der vergangenen Jahre live im klinischen Umfeld zu erleben. Die dänischen Medizinerinnen und Mediziner zeigten sich von der einfachen Handhabung des Systems überzeugt und haben Interesse an der Fortführung der Entwicklung hin zu einem Medizinprodukt“, fasst Iwan Schie zusammen. Neben medizinischen Vorteilen könnte das invaScope einen wirtschaftlichen Nutzen bieten: Teure und aufwändige Operationen mit Operateuren, Anästhesisten und Schwestern ließen sich aufgrund einer verbesserten Diagnostik besser planen und könnten zielgerichteter durchgeführt werden. Dadurch könnten Kosten im Gesundheitssystem gespart werden.
Der endoskopische Ansatz und die unkomplizierte Bedienung des Systems erlauben perspektivisch, weitere schwer erreichbare Körperregionen als Anwendungsfelder zu erschließen. In einer nächsten klinischen Studie soll die Eignung des Systems zur Diagnose von Krebstumoren im Hals- und Kopfbereich gezeigt werden.
Tumorranderkennung mit Dreifachbildgebung
Forschende des Leibniz-IPHT haben gemeinsam mit der Firma Grintech aus Jena ein multimodales Endoskop für eine verbesserte Tumorranderkennung erforscht und entwickelt.
Bisher sind Chirurginnen und Chirurgen auf die Befunde der Schnellschnittdiagnostik angewiesen, um noch während des Eingriffs erkennen zu können, ob ein Tumor vollständig entfernt worden ist. Die Beurteilung der Ergebnisse erfordert langjährige Erfahrung und ist trotz alledem mitunter fehlerhaft. Erst eine spätere intensive pathologische Untersuchung des entnommenen Gewebes liefert Gewissheit. Bis zu vier Wochen können vergehen, bis ein genauer Befund vorliegt. Für Patientinnen und Patienten eine Zeit quälender Ungewissheit — in der sich eventuell verbliebene Tumorzellen bereits wieder vermehren können.
Die Wissenschaftlerinnen und Wissenschaftler des Leibniz-IPHT haben ein Diagnoseverfahren erforscht, das die bisherige Prozedur revolutionieren könnte: Das Endomikroskop ist in der Lage, in-vivo während einer Operation verlässlich gesundes von tumorösem Gewebe in Echtzeit zu unterscheiden. Das System vereint hierzu einen leistungsstarken Laser, eine innovative optische Glasfaser sowie ein endomikroskopisches Objektiv.
„Im vorangegangenen Projekt ,MediCARS‘ haben wir ein Verfahren zur multimodalen Gewebediagnostik erforscht. Die hier gesammelten Erfahrungen haben wir nun in ein miniaturisiertes flexibles Endoskop-Design überführt. Gemeinsam mit unserem Partner, der Grintech GmbH, ist so eines der kompaktesten und leistungsfähigsten Endoskope für die schonende In-vivo-Bildgebung entstanden – eine noch kleinere Realisierung ist kaum möglich“, erklärt Dr. Tobias Meyer-Zedler, Leiter der Arbeitsgruppe Molekulare Bildgebung in der Abteilung Spektroskopie / Bildgebung am Leibniz-IPHT.
Um möglichst viele Informationen aus dem zu untersuchenden Gewebe generieren zu können, kombinierten die Forschenden drei Bildgebungstechniken: die kohärente Anti-Stokes-Raman-Streuung, die Frequenzverdopplung sowie die Zwei-Photonen-angeregte Fluoreszenzmikroskopie. Dieser multimodale Ansatz macht markierungsfrei Gewebestrukturen sowie deren molekulare Zusammensetzung und Morphologie bis in den Submikrometerbereich sichtbar. „Die generierten Bilder können selbst mit denen hochauflösender High-End-Mikroskope mithalten“, resümiert der Forscher.
Ein wichtiger Meilenstein bei der Entwicklung bildete die Realisierung der optischen Doppelkern-Doppelmantel-Glasfaser, die sowohl für die Laserführung als auch für die Signalerfassung konzipiert wurde. Mit der Expertise aus mehreren Jahrzehnten Erfahrung entwickelten die Faserexperten am Leibniz-IPHT eine mikrostrukturierte Faser bestehend aus zwei Kernen zur Führung der beiden Anregungslaser für die kohärente Anti-Stokes-Raman-Streuung, mit denen das Gewebe aus beiden Kernen mit Licht bestrahlt wird. Umgeben sind die beiden Kerne von einem äußeren Mantel, der die Antwort des Gewebes auf die Anregung durch Laserlicht sammelt.
„Um das Konzept fit für die klinische Anwendung zu machen, stehen noch weitere Herausforderungen bevor: So werden wir das Endoskop technologisch weiter verfeinern und klinischen Tests unterziehen. Die Zulassung als Medizinprodukt wird ein weiterer wichtiger Meilenstein sein. Schon in einigen Jahren könnte unser Endoskop dazu beitragen, die Krebsdiagnostik minimalinvasiv optimal zu unterstützen“, so Tobias Meyer-Zedler.
1Vgl. Statista: Zahl der Krebsneuerkrankungen weltweit nach Krebsart im Jahr 2020
2Vgl. Statista: Zahl der Krebstodesfälle nach Krebsart weltweit 2020



