- Startseite
- Forschungsabteilungen
- Nanoskopie
- Forschungsergebnisse
- Oberflächencharakterisierung von Amyloid Fibrillen
Oberflächencharakterisierung von Amyloid Fibrillen
29.02.2016
Die Entstehung von Amyloid Fibrillen ist auf die Falschfaltung von Proteinen zurückzuführen und wird im Zusammenhang mit der Entstehung von neurodegenerativen Erkrankungen diskutiert. Eine detaillierte Charakterisierung solcher Proteinaggregate mit der Spitzen-verstärkten Raman Spektroskopie (TERS) kann einen wichtigen Beitrag zum Verständnis der chemischen Zusammensetzung auf der Nanometerskala liefern.
Von: TANJA DECKERT-GAUDIG, VOLKER DECKERT
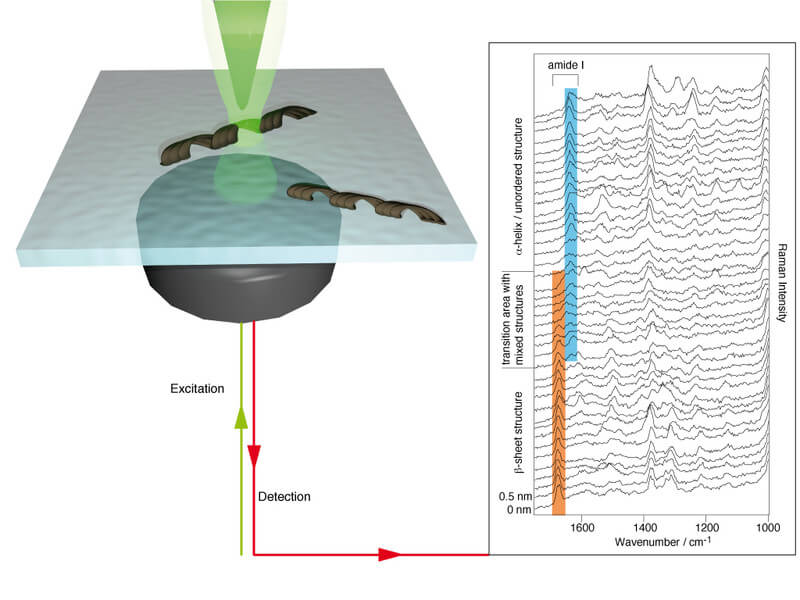
Amlyoid Fibrillen sind Proteinaggregate, deren Ablagerungen Zellen und Gewebe irreversibel schädigen können und als Auslöser schwerwiegender Erkrankungen wie beispielsweise Diabetes Typ II oder Alzheimer diskutiert werden. Die faserförmigen verdrillten Strukturen haben eine Länge von mehreren 100 nm bis hin zu mehreren Mikrometern. Bisher sind weder der exakte Bildungsmechanismus noch der Auslöser der Fibrillierung bekannt. Eine exakte chemische Charakterisierung von Fibrilloberflächen ist in diesem Zusammenhang von großem Interesse, da Informationen über diese Grenzfläche Hinweise zur Fibrillbildung geben können und dort der erste Kontakt mit der Umgebung stattfindet. In den letzten Jahren hat sich die Spitzen-verstärkte Raman Spektroskopie (tip-enhanced Raman scattering – TERS) als geeignete Analysemethode auf diesem Gebiet erwiesen. Das Abrastern der Fibrilloberfläche mit einem Rasterkraftmikroskop und die simultane Detektion von Raman Spektren ermöglichen die morphologische und chemische Charakterisierung in einem Experiment – auf Einzel-Fibrill Basis mit einer Ortsauflösung im Nanometer Bereich. Die intrinsisch hohe Spezifität der Raman Spektroskopie ermöglicht die Klassifizierung und Unterscheidung von Aminosäuren und Sekundärstrukturen auf Fibrillen. So konnte beispielweise auf Amyloid Fibrillen von Insulin und Amylin nachgewiesen werden, dass die Oberflächen immer eine Mischung aus α-helix / ungeordneten Strukturen und β-Faltblatt Strukturen enthalten. Diese Ergebnisse erweitern das Wissen über Amyloid Fibrillen, deren Kern ausschließlich aus β-Faltblatt Strukturen aufgebaut ist.
In TERS Experimenten an Amylin Fibrillen, die bei unterschiedlichen pH Werten generiert wurden, konnte gezeigt werden, dass der Säuregrad des Milieus einen Einfluss auf die chemische Oberflächenzusammensetzung der Fibrillen hat. So weisen Fibrillen bei pH 2 einen geringeren Anteil an α-helix / ungeordneten Strukturen auf als bei pH 7.8 gewachsene Strukturen. Die Präsenz von Mischstrukturen auf der Fibrilloberfläche deckt sich mit theoretischen Modellen und konnte bisher mit keiner anderen Methode sichtbar gemacht werden.
Gleichzeitig ermöglicht die hohe Sensitivität von TERS und die Präzision der Spitzenpositionierung auf einer Fibrille die Detektion von Sekundärstrukturübergängen, wie in der Abbildung gezeigt wird. Hier wurden Spektren systematisch entlang einer Profillinie auf einer Amylin Fibrille im Abstand von 0.5 nm aufgenommen. Anhand der Lage der für eine Peptidbindung charakteristischen Amid I Bande ist ein Wechsel von geordneten β-Faltblatt Strukturen zu Beginn der Messung zu α-helix / ungeordneten Strukturen zu erkennen. Der Nachweis von molekularen Strukturänderungen innerhalb weniger Nanometer ist nur aufgrund des hohen räumlichen Ortsauflösungsvermögens von TERS möglich. Dieses Merkmal zusammen mit der schon erwähnten Spezifität und Sensitivität erlauben die direkte chemische Oberflächenanalyse einer Vielzahl von biologischen, organischen und anorganischen Proben, die mit anderen Methoden so nicht möglich ist.
In einer aktuellen Studie wurde die Fibrillierung von Amylin in Gegenwart einer Lipiddoppelmembran untersucht. Es wird vermutet, dass Wechselwirkungen dieses Peptids mit Lipiden der Zellmembran eine besondere Rolle bei der Entstehung von Diabetes Typ II spielen. Wie die Experimente zeigen, konnten tatsächlich Lipide auf einzelnen Fibrillen anhand ihrer Markerbanden in den TERS Spektren nachgewiesen werden. Diese Ergebnisse sind ein vielversprechender Ausgangspunkt für zukünftige Experimente, in denen Amyloid Fibrillen auf Zellen und in Gegenwart von potentiellen Reagenzien zur Hemmung der Fibrillbildung untersucht werden sollen.
Gefördert von: EU, COST
