- Startseite
- Forschungsabteilungen
- Nanobiophotonik
- Forschungsergebnisse
- Loop-mediated isothermale DNA-Amplifikation für die vor-Ort-Detektion von humanpathogenen Legionellen aus Wasserproben
Loop-mediated isothermale DNA-Amplifikation für die vor-Ort-Detektion von humanpathogenen Legionellen aus Wasserproben

19.08.2019
Legionellen sind im Wasser lebende Bakterien. Ein schneller Nachweis dieser zum Teil humanpathogenen Mikroorganismen kann mittels einer isothermalen Vervielfältigung (loop-mediated isothermal amplification, LAMP) erfolgen. Dabei wird ein artspezifischer Teilbereich des genetischen Materials der Pathogene amplifiziert. Dazu wurden Methoden mit dem Potential für einen einfachen und kostengünstigen Vor-Ort-Nachweis am Leibniz-IPHT entwickelt, die zudem eine Quantifizierung der Pathogene erlauben.
Legionellen sind in der Natur im Süßwasser aber auch in Trinkwassersystemen vorkommende weitverbreitete Bakterien, die zum Teil humanpathogen sind. Die Art Legionella pneumophila hat eine besondere Bedeutung als Verursacher der Legionärskrankheit. Eine Kontamination von Trinkwasser-Hausinstallationen erfordert eine sofortige Reaktion, um eine aerosolvermittelte Infektion der Lunge auszuschließen. Der derzeitige Standard für den Nachweis von Legionellen ist ein zeitaufwendiger Kultivierungsprozess, was eine schnelle Reaktion im Falle einer Kontamination verhindert. Daher war das Ziel der aktuellen Forschung die Entwicklung von schnellen, vor-Ort-fähigen Nachweismethoden für diese Humanpathogene. Dabei wurde eine kolorimetrische Methode mit isothermaler LAMP-basierter DNA-Vervielfältigung kombiniert (Blue-LAMP). Der Nachweis basiert hierbei auf dem optischen Signal des Farbstoffs Hydroxynaphtholblau (HNB). Bei der LAMP erfolgt eine vergleichsweise starke Bildung von Amplifikaten und Pyrophosphat, letzteres bildet mit Magnesiumionen einen Komplex. Die damit einhergehende Abnahme der Magnesiumkonzentration führt zu einem Farbumschlag von Violett zu Blau des Metallindikator HNB. Dieses Farbsignal erlaubt die Detektion der erfolgten DNA-Amplifikation mit dem bloßen Auge. LAMP ist zudem robuster, rascher und benötigt weniger aufwändige Geräte als die vergleichbare Standardmethode der Polymerase-Kettenreaktion (PCR). So kann LAMP im miniaturisierten Format (hier auf einem stationären Chip) und ohne komplexen technischen Aufwand durchgeführt werden.
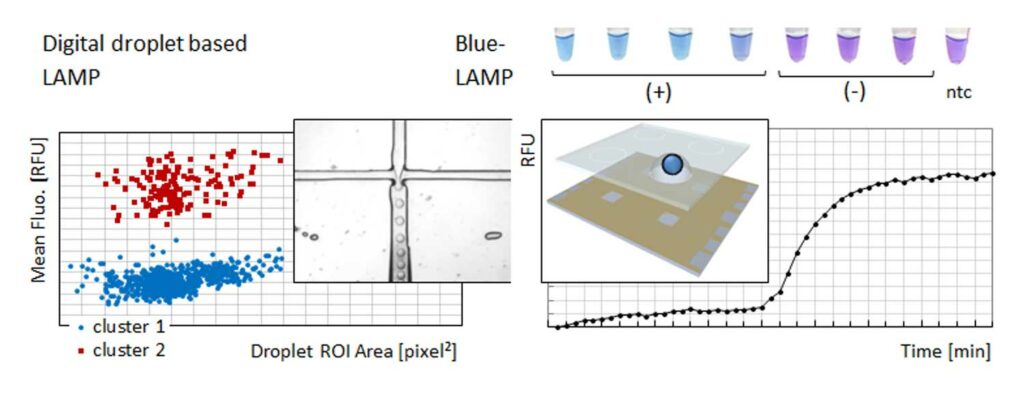
In einem weiteren Ansatz wird der Nachweis in Form eines tropfenbasierten digitalen Assays (droplet digital LAMP – ddLAMP) realisiert, der mithilfe der Poisson-Statistik eine quantitative Aussage über die DNA-Ausgangskonzentration und damit der Pathogenquantität erlaubt. Die Blue-LAMP wurde bezüglich Reaktionsadditiven und anderen Faktoren, wie den Konzentrationen von MgSO4 und HNB, dem verwendeten Genbereich (damit verschiedenen LAMP-Primersystemen von mindestens 4 Primer pro Zielsequenz) sowie Inkubationstemperatur optimiert und die Reaktion hinsichtlich der Nachweisgrenze getestet. Mit einer Inkubationsdauer von ca. 45 Minuten bei 65°C konnte eine DNA-Konzentration von ca. 1 pg/µl reproduzierbar nachgewiesen werden, was ungefähr 270 Molekülen entspricht.
Im Bild:
Isothermale Amplifikation des genetischen Materials der L. pneumophila mittels ddLAMP erlaubt eine exakte Quantifizierung der Pathogen-DNA durch Auswertung des Fluoreszenzsignals in den einzelnen Tröpfchen (links). Durch Miniaturisierung auf den stationären Chip (Gesamttropfengröße unter 15 µl) kann man in einem Ansatz von nur 3 µl einen reproduzierbaren Nachweis der Pathogen erzielen (rechts).
Die Spezifität und Selektivität der Nachweismethode wurde für L. pneumophila im Vergleich zu anderen relevanten Legionellenarten und Trinkwasser-Mikroorganismen in einer Vielzahl von Tests untersucht. Insgesamt zeigen die LAMP-basierten Ansätze eine hohe Spezifität und Sensitivität. Durch die einfache laborunabhängige Durchführbarkeit und der kurzen Reaktionsdauer bei gleichzeitig hoher Effizienz hat die neuentwickelte Methode der Blue-LAMP das Potential zum Einsatz als Schnelltest zum Monitoring der Wasserqualität.
Im Bild oben:
Floureszenz-mikroskopische Aufnahme eines Reaktionsansatzes von Schleifen-vermittelter isothermaler DNA-Amplifikation (ddLAMP): der orange Farbstoff zeigt die Tropfen mit erfolgreicher Amplifikation.