- Startseite
- Technologiegruppen
- Kompetenzzentrum für Mikro- und Nanotechnologien
- Forschungsergebnisse
- Herstellung von 3D-Nanostrukturen für innovative Biosensoren
Herstellung von 3D-Nanostrukturen für innovative Biosensoren
23.04.2018
Erstmals ist es Forschern des Leibniz-IPHTs gelungen, mittels der Atomlagenabscheidung komplexe dreidimensionale Nanoarchitekturen ohne die Zuhilfenahme von vorstrukturierten 3D-Templaten herzustellen. Der einfache zweistufige Prozess ermöglicht die Fertigung großer aktiver Sensorflächen mit geringerem Kostenaufwand, was für Anwendungen insbesondere in den Life-Science-Bereichen interessant ist.
Von Mario Ziegler // Dana Cialla-May // Sezin Yüksel // Sebastian Goerke // Uwe Hübner
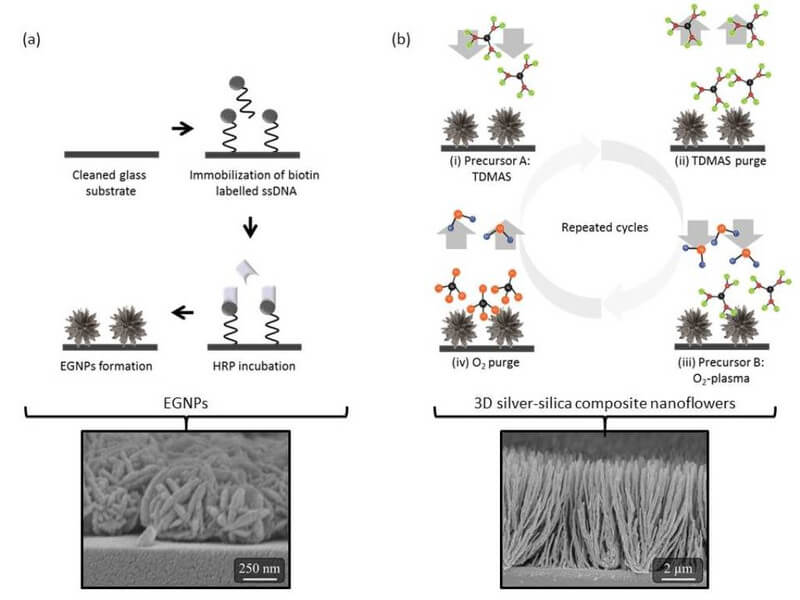
Dreidimensionale (3D) Nanostrukturen zeigen aufgrund der sehr geringen Strukturgröße bei gleichzeitig erhöhtem Interaktionsmedium beispiellose Eigenschaften bei Wechselwirkung mit Licht. Durch die gezielte Anwendung dieser Eigenschaften lassen sich neuartige Sensoren und Detektionsverfahren für den Life-Science-Bereich entwickeln, deren Effekte durch die 3D-Architektur noch weiter verstärkt werden. Die Herstellung von 3D-Mikro- und Nanostrukturen erweist sich jedoch trotz unzähliger Bottom-Up- (z.B. selbst organisierende Monolagen) und Top-Down-Prozesse (z.B. klassische Photolithografie) immer noch als sehr schwierig. Viele Ansätze führen nach einer umfangreichen Prozesskette zu einer einzigen komplexen Struktur. Das macht die Prozesse unflexibel und zum Teil auch sehr kostenintensiv. Eine Verwendung dieser Strukturen im Life-Science-Bereich ist somit nicht praktikabel. Das in Kooperation von IPHT und FSU Jena entwickelte Verfahren ermöglicht es, 3D-Nanostrukturen durch einen einfachen zweistufigen Prozess herzustellen. Die finale Nano-Architektur lässt sich durch mehrere Parameter individuell anpassen und ermöglicht somit die Herstellung verschiedenster Strukturen für ein breites Spektrum an Anwendungen.
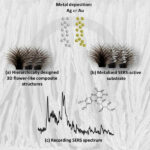
Abb. 1 zeigt schematisch den Prozessablauf für die Herstellung der 3D-Nanostrukturen. Im ersten Schritt wird ein Edelmetall (Gold, Silber, Platin) auf einem Substrat abgeschieden. Dies kann sowohl mittels Nanopartikelsynthese als auch über physikalische Gasphasenabscheidung erfolgen [1]. Im zweiten Schritt wird das vorher abgeschiedene Edelmetall mittels Plasma-unterstützer Atomlagenabscheidung (PEALD, engl. plasma-enhanced atomic layer deposition) mit Siliziumdioxid (SiO2) beschichtet. Im Gegensatz zur klassischen ALD werden die Parameter des Abscheideprozesses dahingehend verändert, dass das Edelmetall eine metastabile Phase ausbildet. Die metastabile Phase tritt durch das zyklische Verhalten des ALD-Prozesses zeitlich limitiert auf. Dadurch sind im ALD-Reaktor zu verschiedenen Zeiten abwechselnd das Edelmetall und eine metastabile Phase des Edelmetalls vorhanden. Während die Beschichtung des Edelmetalls zu einer planaren (2D) Abscheidung führt, resultiert durch die Beschichtung der metastabilen Phase eine Transformation der Oberfläche zu 3D-Architekturen.
Das rührt daher, dass im Plasmaabschnitt des ALD-Prozesses (Abb. 1b III) Plasmateilchen mit dem Substrat reagieren. Dabei kommt es zu einer Volumenzunahme in den ersten Atomlagen der Substratoberfläche. Das Substrat wird stellenweise durch die Volumenzunahme angehoben und beginnt, poröse Strukturen auszubilden. Im Gegensatz zur strukturellen Transformationen ist die Volumenzunahme jedoch aufgrund der ausgebildeten metastabilen Phase ein reversibler Prozess, währenddessen die in die Substratoberfläche eingebauten Plasmateilchen wieder freigesetzt werden. Durch eine entsprechende Parameterwahl im ALD-Prozess lassen sich auf dieser Grundlage verschiedenartige Strukturen generieren (Abb. 2).
Zur Einschätzung der Leistungsfähigkeit für biophotonische Anwendungen wurden die Strukturen in einem Messaufbau für oberflächenverstärkte Raman-Spektroskopie (SERS, engl. surface-enhanced Raman spectroscopy) untersucht [2]. Es zeigte sich, dass die 3D-Nanostrukturen keine signifikanten Raman-Banden zeigen (Abb. 3a). Es kann somit als ideales Template für SERS-Messungen genutzt werden, wobei ein für die Untersuchung geeignetes plasmonisch-aktives Material vor den Messungen auf den Strukturen abgeschieden wird (Abb. 3b). Die Messungen ergaben zudem eine sehr gute Reproduzierbarkeit der Ergebnisse über die gesamte Chipfläche sowie auch von Batch zu Batch. Um die Verwendbarkeit der Strukturen für Kleinstkonzentrationen abschätzen zu können, wurden die SERS aktiven Strukturen mit Riboflavin benetzt (Abb. 3c). Riboflavin wurde im Bereich von 5 bis 0,025 µM gemessen, wobei die zuverlässige Detektionsgrenze bei 50 nM liegt.
Gefördert von: BMBF, DFG