- Startseite
- Forschungsabteilungen
- Faserphotonik
- Forschungsergebnisse
- Sensorik basierend auf lokalisierten Oberflächenplasmonen
Sensorik basierend auf lokalisierten Oberflächenplasmonen
23.04.2018
Bereiche immobilisierte Gold-Nanopartikeln werden als hochempfindliche plasmonbasierte Brechungsindex-Sensoren eingesetzt. Eine Adsorption von Molekülen an der Oberfläche der Nanopartikel bewirkt eine Änderung im Brechungsindex, daher kann dieses Konzept auch für den Nachweis von Biomolekülen verwendet werden. Die Notwendigkeit desNachweises extrem niedriger Molekülkonzentrationen erfordert eine zunehmende Empfindlichkeit dieser Sensoren. Deshalb haben wir verschiedene Ansätze untersucht, die bezüglich einer Verbesserung von Sensoren auf Basis lokalisierter Oberflächenplasmonen vielversprechend sind.
Von Ondrej Stranik // Brenda Doherty // Andrea Csaki
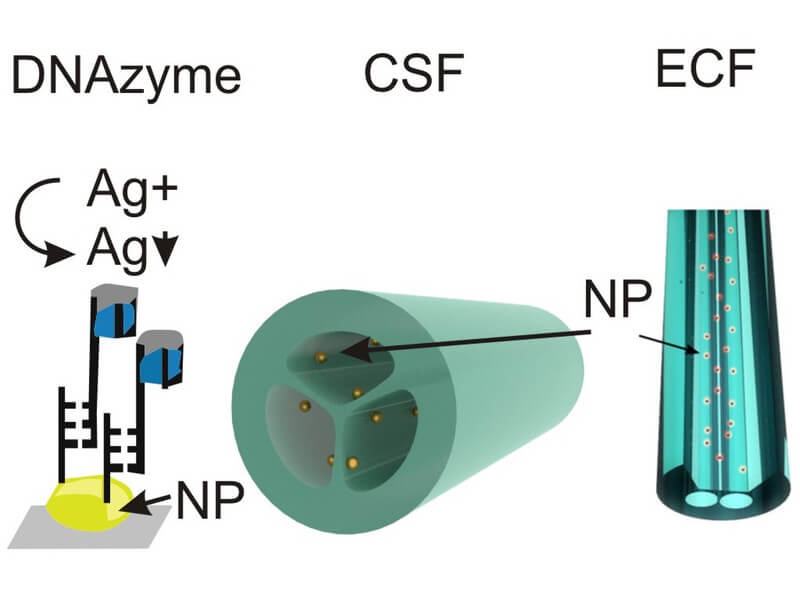
Kleine metallische Nanopartikel (NP) besitzen besondere optische Eigenschaften, die im großvolumigen Metall nicht vorhanden sind. Sie absorbieren und streuen das Licht resonant bei einer bestimmten Wellenlänge (die sogenannte lokalisierte Oberflächenplasmonen¬resonanz (engl. localized surface-plasmon resonance, LSPR)), was ihnen eine bestimmte Farbe verleiht. Diese Farbe ändert sich bei Adsorption von nanometerdünnen Schichten auf den Nanopartikeln, weshalb sie für den markierungsfreien Nachweis von Biomolekülen genutzt werden können. Mit Bio-Erkennungsrezeptoren modifizierte Nanopartikel werden mit der untersuchten Probe in Kontakt gebracht und anschliessend spektroskopisch vermessen. Eine Farbänderung der Nanopartikel zeigt die Anwesenheit des gesuchten Analyten an. Die bisherigen Untersuchungen zur LSPR-Sensorik konzentrierten sich auf zwei Richtungen. Erster Forschungsschwerpunkt war die Erhöhung der Nachweisempfindlichkeit durch die Einbringung eines Peroxidase-nachahmenden DNAzyms in das DNA-Nachweissystem [1]. Das DNAzym ist ein Komplex, welcher aus einer spezifischen DNA (G-Quadruplex-bildende DNA) und einem Hämin-Molekül gebildet wird. Die Vorteile bei der Verwendung eines DNAzyms gegenüber klassischen enzymatischen Proteinen als Marker liegen in der thermischen Stabilität und der einfachen Implementierung in DNA-Molekülen. Unsere Untersuchungen haben gezeigt, dass das DNAzym in der Lage ist, eine Silberabscheidung auf goldmetallischen Nanopartikeln zu katalysieren. Dieser Effekt kann zur Verbesserung des LSPR-Nachweises von spezifischer DNA ausgenutzt werden. Beim klassischen LSPR-Nachweis von DNA bewirkt die spezifische Bindung von DNA eine Verschiebung des Plasmonresonanzpeaks um einige nm. Die zusätzliche Silberabscheidung auf dem NP, initiiert durch den DNAzym-Marker, bewirkt eine deutlichere Verschiebung der Plasmonenresonanz oder gar eine komplette Veränderung des Resonanzpeaks. Die topologische Charakterisierung des abgeschiedenen Silbers zeigte, dass die mittels DNAzym auf 100 nm Gold-NP gewachsene Silberhülle eine stark anisotrope Sternform mit einer durchschnittlichen Dicke von 20 nm aufweist.
Ein zweiter Schwerpunkt war die Verbesserung des optischen Nachweises durch die Implementierung der metallischen Nanopartikel in neuartige mikrostrukturierte optische Fasern wie Suspended-Core- [2] und Exposed-Core-Fasern [3]. Suspended-Core-Fasern (SCF) sind mikrostrukturierte Fasern mit axialen Luftkanälen, die sich entlang der Faserlänge erstrecken und Durchmesser von mehreren zehn Mikrometern aufweisen. Diese Kanäle sind so angeordnet, dass sie einen zentralen Glaskern bilden, in welchem die sich ausbreitenden Mode per Evaneszenz tief in die Luftkanäle eindringt. Die SCF verspricht eine kompakte, einfach zu bedienende LSPR-Sensorikplattform, da ihre Geometrie eine effiziente optische Anregung von LSPR bei im Inneren der Faser abgeschiedenen NP ermöglicht. Gleichzeitig ermöglicht die Fasergeometrie einen effizienten Transport winziger Volumina einer flüssigen Probe zu den NP. Uns gelang es, Gold-NP über mehrere Meter entlang einer SCF mit steuerbarer NP-Dichte homogen abzulagern. Dies war wichtig, da eine zu hohe Dichte der abgeschiedenen NP zu einem völligen Erliegen der Lichtausbreitung entlang der SCF führen würde. Diese LSPR-Sensorikplattform zeigte eine verbesserte Signalantwort auf eine Änderung des Brechungsindex der Flüssigkeit im Inneren der SCF (167 nm/RIU) im Vergleich zu dem Licht, das nicht durch die Fasern geleitet wurde (eine etwa 1,5-fache Verstärkung). Eine weitere Variante dieser Idee war die Verwendung von Exposed-Core-Fasern (ECF). Diese ähneln SCF, jedoch sind ihre Luftkanäle axial offen. Diese Eigenschaft hat den zusätzlichen Vorteil der Kontrolle der axialen Begrenzung der NP-Abscheidung auf der Faser. Die gemessene Brechungsindexempfindlichkeit in diesen ECF erreichte 200 nm/RIU.
Gefördert von: BMBF, AIF
